Интерпретация диагностических тестов на SARS-CoV-2
Nandini Sethuraman, MD; Sundararaj Stanleyraj Jeremiah, MD; Akihide Ryo, MD, PhD
Это перевод одноименной статьи, опубликованный 6 мая в Журнале Американской медицинской Ассоциации (JAMA)
https://jamanetwork.com/journals/jama/fullarticle/2765837?guestAccessKey=61b73a23-25e1-46bd-96c5-cf0ec847df25&utm_source=twitter&utm_medium=social_jama&utm_term=3324078795&utm_campaign=article_ alert&linkId=88064719.Перевод выполнен Т.И. Якивчиком, ред. д.м.н. Г.Э. Улумбекова.
Пандемия коронавирусной болезни 2019 г. (COVID-19) продолжает поражать население большей части мира. Ежедневно пополняются знания о диагностических тестах для своевременного выявления тяжелого острого респираторного синдрома, вызванного коронавирусом 2 типа (SARS-CoV-2). Важное значение имеет ясное понимание природы тестов и интерпретация их результатов. В настоящей статье описывается как интерпретировать два типа диагностических тестов, обычно используемых для выявления инфекции, вызванной SARS-CoV-2, а именно: обратная транскриптазно- полимеразная цепная реакция (далее — ОТ-ПЦР) и иммуноферментный анализ на IgM и IgG (далее — ИФА). В статье также рассмотрено, как могут изменяться результаты с течением времени (рис .1).
Обнаружение вирусной РНК методом ОТ-ПЦР
До сих пор наиболее часто используемым и надежным тестом для диагностики COVID-19 был тест РТ-ПЦР, выполненный с использованием мазков из носоглотки или других образцов из дыхательных путей, включая мазок из горла или, в последнее время, слюну. Различные производители используют разные гены-мишени РНК вируса, причем большинство тестов нацелено на один или более генов оболочки (envelope), нуклеокапсида (N), спайк-белка (s), РНК-зависимой РНК-полимеразы (RdRp) и ORF1. По данным сравнительных исследований, чувствительность тестов к отдельным генам сопоставима, за исключением праймерного зонда RdRp-SARSr (Charité), который имеет несколько более низкую чувствительность, вероятно, из-за несоответствия в обратном праймере (короткий фрагмент нуклеиновой кислоты комплементарный ДНК- или РНК-вируса).
У большинства пациентов с симптоматической инфекцией COVID-19 вирусная РНК в мазке из носоглотки, измеренная с помощью порогового цикла (Ct — Пц), обнаруживается уже в первый день симптомов и достигает пика в течение первой недели их появления. Пороговый цикл – это количество циклов репликации, необходимых для получения флуоресцентного сигнала, чем ниже значения порогового цикла, тем выше нагрузки вирусной РНК. Значение порогового цикла менее 40 клинически регистрируется как ПЦР- положительный результат. Эта позитивность начинает снижаться к третьей неделе и впоследствии становится незаметной. Однако, значения порогового цикла, полученные у тяжелобольных госпитализированных пациентов, ниже, чем значения при легких случаях течения болезни. Положительная ПЦР-активность может сохраняться и после 3-х недель с начала заболевания, когда большинство легких случаев уже дают отрицательный результат.2 Однако «положительный» результат ПЦР отражает только обнаружение вирусной РНК и не обязательно указывает на наличие жизнеспособного вируса. 3
Рис. 1 Приблизительные изменения в результатах диагностических тестов для выявления инфекции SARS-CoV-2 относительно начала проявления симптомов
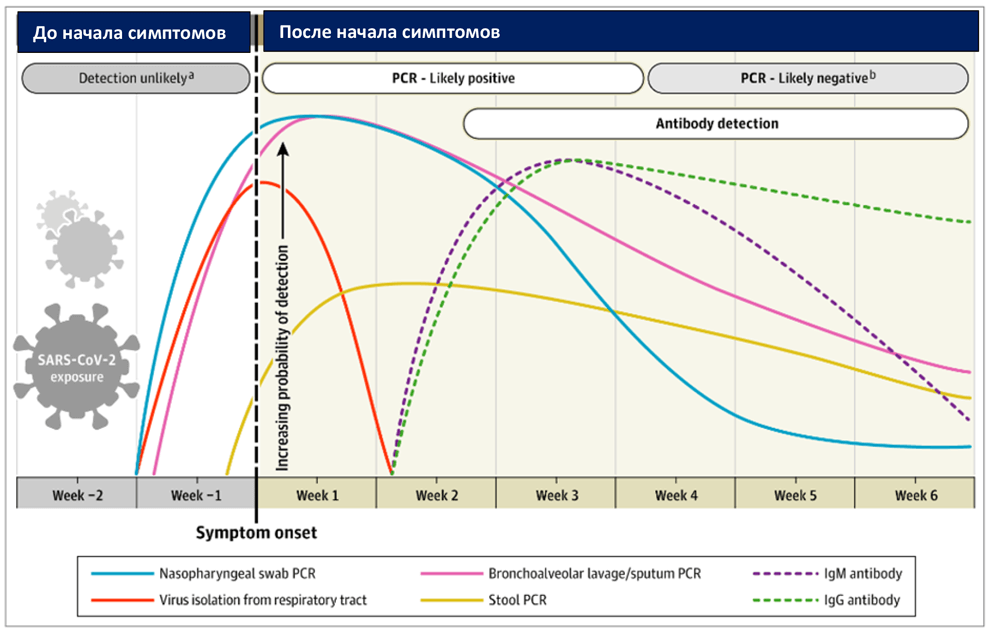
Приблизительные временные интервалы и темпы обнаружения вирусов основаны на данных нескольких опубликованных отчетов. Из-за вариативности значений в исследованиях расчетные интервалы времени следует считать приблизительными, однако вероятность обнаружения инфекции SARS-CoV-2 представлена качественно. На SARS-CoV-2 также указывает тяжелый острый респираторный синдром, вызванный коронавирусом 2 типа; ПЦР (полимеразная цепная реакция).
- Обнаружение происходит только в том случае, если пациенты находятся под активным наблюдением с момента контакта с зараженным.
- Чаще всего регистрируется отрицательный результат ПЦР мазка из носоглотки.
В некоторых случаях вирусная РНК была обнаружена методом ОТ-ПЦР даже после шестой недели после первого положительного теста. Также сообщалось о нескольких случаях с положительными результатами после двух последовательных отрицательных ПЦР-тестов, выполненных с интервалом в 24 часа. Неясно, является ли это ошибкой тестирования, повторной инфекцией или реактивацией имеющегося вируса. При исследовании девяти пациентов попытки выделить вирус в культуре после восьмого дня с начала заболевания не увенчались успехом, что соответствует информации о снижении инфективности (заразности) после первой недели.3 Отчасти именно поэтому «стратегия, основанная на симптомах», которая применяется в Центре по контролю и профилактике заболеваний (CDC) указывает, что медицинские работники могут вернуться к работе, если «с момента выздоровления, от момента, определяемого как отсутствие лихорадки (без использования жаропонижающих препаратов) и улучшение респираторных симптомов (например, кашель, одышка), прошло, по крайней мере три дня (72 часа); а с момента появления первых симптомов – не менее 10 дней». 4
Время положительного результата ПЦР отличается в мазке из носоглотки и в других образцах. ПЦР-позитивность в слюне снижается медленнее и может быть положительной и после того, как мазки из носоглотки будут отрицательными. 3 В одном исследовании ПЦР- позитивность в стуле наблюдалась у 55 из 96 (57%) инфицированных пациентов и оставалась положительной в стуле в среднем от 4 до 11 дней, но не была связана с клинической тяжестью заболевания.2 Персистенция ПЦР в слюне и стуле близка по оценкам Wölfel et al.3
При исследовании 205 пациентов с подтвержденной инфекцией COVID-19 позитивность ОТ-ПЦР была наиболее высокой в образцах бронхоальвеолярного лаважа (93%), за ним следовали мокрота (72%), мазок из носа (63%) и мазок из глотки (32%).5 Ложноотрицательные результаты были получены главным образом из-за неправильного времени забора проб от начала заболевания и из-за ошибок в технике их взятия, особенно это касается мазков из носоглотки. Специфичность большинства тестов ОТ-ПЦР составляет 100%, поскольку конструкция праймера специфична для геномной последовательности SARS-CoV-2. Иногда ложноположительные результаты могут возникать из-за технических ошибок и загрязнения реагентами.
Обнаружение антител к инфекции SARS-CoV-2 COVID-19
Инфекция COVID-19 также может быть обнаружена косвенно путем измерения иммунного ответа на инфекцию SARS-CoV-2. Серологическая диагностика особенно важна для пациентов с легкой и средней степенью тяжести заболевания, у которых признаки заболевания могут появиться поздно, после первых двух недель от его начала. Кроме того, серологическая диагностика становится важным инструментом для понимания степени распространения COVID-19 среди населения и выявления лиц, обладающих иммунитетом и потенциально «защищенных» от заражения.
Наиболее чувствительным и ранним серологическим маркером являются общие антитела, уровень которых начинает повышаться со второй недели появления симптомов. 6 Хотя ИФА IgM и IgG были признаны положительными уже на четвертый день после появления симптомов, более высокие уровни наблюдаются на второй и третьей неделе болезни.
Например, сероконверсия IgM и IgG наблюдалась у всех пациентов между третьей и четвертой неделями клинического начала заболевания (по результатам у 23 пациентов по данным Xiang et al.).8 После этого концентрация IgM начинает снижаться и достигает более низких уровней к пятой неделе и почти исчезает к седьмой неделе, в то время как IgG сохраняется и после 7 недель.9 В исследовании 140 пациентов комбинированная чувствительность ПЦР и IgM-ИФА, направленная на нуклеокапсидный антиген (НК), составила 98,6% против 51,9% проведения только ПЦР-теста. В течение первых 5,5 дней, количественный ПЦР имел более высокий коэффициент позитивности, чем ІgМ, а ІgМ- ИФА имел более высокий коэффициент позитивности после 5,5 дней болезни.10
ИФА-тесты на IgM и IgG антитела имеют более чем 95% специфичности для диагностики COVID-19. Тестирование парных образцов сыворотки крови с начальной ПЦР и второй ПЦР через две недели может еще больше повысить диагностическую точность. Как правило, большинство антител вырабатывается против самого распространенного белка вируса, которым является нуклеокапсид (НК). Поэтому тесты, которые обнаруживают антитела к НК, будут наиболее чувствительными. Однако, рецептор-связывающий домен белка S (RBD-S), с помощью которого вирус связывается с рецептором клетки-мишени, наиболее важен. Считается, что антитела, которые вырабатываются к нему, более специфичны, и как ожидается, являются нейтрализующими. Поэтому использование одного или обоих антигенов для обнаружения IgG и IgM приведет к более высокой чувствительности.7 Антитела, однако, могут иметь перекрестную реактивность с SARS-CoV и, возможно, с другими коронавирусами.
Экспресс-тесты на выявление антител, проводимые непосредственно на месте оказания медицинской помощи, хорошо разработаны, доступны и имеют разное качество. Многие производители не раскрывают природу используемых антигенов. Эти тесты носят исключительно качественный характер и могут указывать только на наличие или отсутствие антител к SARS-CoV-2. Наличие нейтрализующих антител может быть подтверждено только тестом на реакцию нейтрализации бляшкообразования (plaque reduction neutralization test). Однако, известно, что высокие титры IgG-антител, выявленные методом ИФА, положительно коррелируют с нейтрализующими антителами.7 Долгосрочная персистенция (наличие в крови) и продолжительность защиты, обеспечиваемой нейтрализующими антителами, остаются неизвестными.
Выводы
Используя имеющиеся данные, была разработана клинически полезная шкала диагностических маркеров для выявления COVID-19 (см. рис. 1). Представленные данные относятся к взрослым группам населения, без нарушений иммунитета. Время обнаружения положительной реакции ПЦР и сероконверсии может быть отличным у детей, а также у других групп, включая большую популяцию бессимптомных носителей, которые остаются не диагностированными без активного отслеживания контактов. Остаётся много вопросов относительно того, как долго сохраняется потенциальный иммунитет у лиц, инфицированных SARS-CoV-2 и перенесших его с симптомами и без симптомов.
Автор: доктор Сандарарай Станлерай Иеремия, Отделение микробиологии и молекулярных биозащитных исследований, медицинский факультет Университета Йокогамы, 3-9 Фукуура, Каназава-ку, Йокогама 236-0004, Япония (rediffjerry@gmail.com).
Ссылки на литературу
1.
Nalla AK , Casto AM , Huang MW , et al. Comparative performance of SARS-CoV-2 detection assays using seven different primer/probe sets and one assay kit. J Clin Microbiol. 2020;JCM.00557-20. Published online April 8, 2020. doi:10.1128/JCM.00557-20PubMedGoogle Scholar
2.
Zheng S , Fan J , Yu F , et al. Viral load dynamics and disease severity in patients infected with SARS-CoV-2 in Zhejiang province, China, January-March 2020: retrospective cohort study. BMJ. 2020;369:m1443. Published online April 21, 2020. doi:10.1136/bmj.m1443PubMedGoogle ScholarCrossref
3.
Wölfel R , Corman VM , Guggemos W , et al. Virological assessment of hospitalized patients with COVID- 2019. Nature. 2020. Published online April 1, 2020. doi:10.1038/s41586-020-2196-xPubMedGoogle Scholar
4.
CDC. Return-to-work criteria for healthcare workers. Updated April 30, 2020. Accessed May 3, 2020. https://www.cdc.gov/coronavirus/2019-ncov/hcp/return-to-work.html
5.
Wang W , Xu Y , Gao R , et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA. 2020. Published online March 11, 2020. doi:10.1001/jama.2020.3786 ArticlePubMedGoogle Scholar
6.
Lou B , Li T , Zheng S , et al Serology characteristics of SARS-CoV-2 infection since the exposure and post symptoms onset. medRxiv. Preprint posted March 27, 2020. doi:10.1101/2020.03.23.20041707
7.
To KK-W , Tsang OT-Y , Leung W-S , et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis. 2020;20(5):565-574. doi:10.1016/S1473-3099(20)30196-1PubMedGoogle ScholarCrossref
8.
Xiang F , Wang X , He X , et al. Antibody detection and dynamic characteristics in patients with COVID-19. Clin Infect Dis. 2020;ciaa461. Published online April 19, 2020. doi:10.1093/cid/ciaa461PubMedGoogle Scholar
9.
Xiao AT , Gao C , Zhang S . Profile of specific antibodies to SARS-CoV-2: the first report. J Infect. 2020;S0163- 4453(20)30138-9. Published online March 21, 2020. doi:10.1016/j.jinf.2020.03.012PubMedGoogle Scholar
10.
Guo L , Ren L , Yang S , et al. Profiling early humoral response to diagnose novel coronavirus disease (COVID- 19). Clin Infect Dis. 2020;ciaa310. Published online March 21, 2020. doi:10.1093/cid/ciaa310PubMedGoogle Scholar.
